Onco.UroWeb.ru - Онкоурология
Onco.UroWeb.ru - Онкоурология
|
|
Заболевания >> Диагностика и лечение герминогенных опухолей яичекМатериал подготовил к.м.н. Сорокин Константин Владимирович ДИАГНОСТИКА И ЛЕЧЕНИЕ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ ЯИЧЕКЕвропейский консенсус по диагностике и лечению герминогенных опухолей: доклад Европейской согласительной группы по герминогенным опухолямH.J. Schmoll, R. Souchon, S. Krege, P. Albers, J. Beyer, C. Kollmannsberger, S.D. Fossa, N.E. Skakkebaek, R. de Wit, K. Fizazi, J.P. Droz, G. Pizzocaro, G. Daugaard, P.H.M. de Mulder, A. Horwich, T. Oliver, R. Huddart, G. Rosti, L. Paz Ares, O. Pont, J.T. Hartmann, N. Aass, F. Algaba, M. Bamberg, I. Bodrogi, C. Bokemeyer, J. Classen, S. Clemm, S. Culine, M. de Wit, H.G. Derigs, K.P. Dieckmann, M. Flasshove, X. Garcia del Muro, A. Gerl, J.R. Germa-Lluch, M. Hartmann, A. Heidenreich, W. Hoeltl, J. Joffe, W. Jones, G. Kaiser, O. Klepp, S. Kliesch, L. Kisbenedek, K.U. Koehrmann, M. Kuczyk, M.P. Laguna, O. Leiva, V. Loy, M.D. Mason, G.M. Mead, R.P. Mueller, N. Nicolai, G.O.N. Oosterhof, T. Pottek, O. Rick, H. Schmidberger, F. Sedlmayer, W. Siegert, U. Studer, S. Tjulandin, H. von der Maase, P. Walz, S. Weinknecht, L. Weissbach, E. Winter, C. Wittekind European Germ Cell Cancer Consensus Group (EGCCCG) ВведениеВ настоящее время герминогенные опухоли яичка стали моделью курабельной злокачественной опухоли. Главным фактором высокой курабельности является уникальная чувствительность герминогенной опухоли яичка к различным химиотерапевтическим препаратам, в частности, к цисплатину. В выработке современных стандартов лечения большое значение имели результаты проспективных рандомизированных исследований, которые ответили на ряд важных вопросов касательно роли хирургии, лучевой терапии, химиотерапии и внедрили междисциплинарный подход в программу лечения герминогенной опухоли яичка. Огромная доказательная база, полученная в результате этих исследований, позволяет врачам и пациентам при планировании лечения выбирать наиболее эффективные и наименее токсичные методики. Однако выбор оптимального вида лечения бывает затруднен, особенно при ранних стадиях болезни, когда излечение возможно при минимальном вмешательстве, и пациенты имеют реальный риск быть «перелеченными». Лечение больных с распространенным процессом, рецидивом или рефрактерной опухолью также зачастую представляет определенные сложности, и эти пациенты не всегда получают медицинскую помощь в оптимальном объеме. Герминогенные опухоли яичка являются редкой патологией, которая требует лечения и наблюдения у специалистов, обладающих соответствующим опытом. Доказательством этого является прямая зависимость выживаемости больных с распространенными от квалификации врачей, лечивших их (1) (СДМ III, (степень доказательности в медицине: определение уровня научной доказательности, предложенное Агентством по Здравоохранению и Науке США) (2). Уровни доказательности, приводимые в данной статье, представлены в таблице 1. Опыт специалистов можно точно определить по числу пациентов, получающих лечение в их отделении (СДМ III). Естественно, что большой поток больных повышает компетентность врачей, что позволяет принимать правильные решения даже в нетипичных ситуациях, а также способствует «концентрации» пациентов с герминогенной опухолью яичка в определенных специализированных центрах. Важным шагом явилось создание Европейской Согласительной Группы по герминогенным опухолям (European Germ Cell Cancer Consensus Group (EGCCCG)) и выработка всеобъемлющего и современного консенсуса, в котором на основе имеющейся доказательной научной базы сформулированы стандарты диагностики и лечения герминогенной опухоли яичка. Пациенты и методы22-23 ноября 2002 г. в Эссене (Германия) Немецкой Исследовательской Группой по изучению рака яичка (German Testicular Cancer Study Group (GTCSG)) была проведена Европейская Согласительная конференция по диагностике и лечению герминогенных опухолей. Из многих стран Европы были приглашены химиотерапевты, лучевые терапевты, урологи и патоморфологи. Выбор экспертов основывался на научном вкладе, сделанном в области диагностики и лечения герминогенных опухолей яичка. Целью конференции было определение текущего стандарта лечения с использованием методологии доказательной медицины (ДМ) (таблица 1) (2, 3). За 2 года до этого члены GTCSG сделали обзор доступной литературы в соответствии со стандартами ДМ и опубликовали национальное немецкое руководство по диагностике и лечению герминогенных опухолей яичка (4,5). Последнее было заранее разослано всем приглашенным участникам вместе с двумя аналогичными руководствами из других европейских стран, основанными на стандартах ДМ, (6, 7) в качестве основы для обсуждения. Первоначальный текст был подготовлен инициативной группой, прочитан и обсужден всеми участниками. Все участники EGCCCG согласились с окончательным вариантом. Таблица 1. Градация научной доказательности (уменьшающаяся от уровня IA до IV) в соответствии с определением Агентства по Здравоохранению и Науке США (2) (US Department of Human Health Services. Agency for Health Care Policy and Research. Acute pain management: operative or medical procedures and trauma. Rockville (MD): The Agency; 1993. Clinical Practice Guideline No.1. AHCPR Publication No. 92-0023. p. 107).
Диагностика и стадированиеКлиническая картина герминогенных опухолей яичкаУ большинства больных первым симптомом заболевания является появление опухолевого образования в яичке. Отсрочка в диагнозе герминогенных опухолей яичка может быть связана с игнорированием симптомов болезни самим пациентом или врачом, который ошибочно принимает опухолевый узел в яичке за эпидидимит (СДМ III: 8), а боль в спине – за проблемы с позвоночником. Поэтому вышеуказанные жалобы у молодых мужчин должны вызывать онкологическую настороженность. У небольшого числа пациентов первичная опухоль, локализуясь внегонадно (забрюшинно или в средостении), манифестирует с соответствующих симптомов. Около трети больных с внегонадной забрюшинной герминогенной опухолью имеют внутрипротоковую карциному (ВПК) (син. carcinoma in situ, CIS). Еще у трети больных при ультразвуковом исследовании (УЗИ) яичек обнаруживают рубец, свидетельствующий о существовавшей первичной опухоли яичка, которая «сгорела». Это яичко также должно быть удалено. Таким образом, лишь треть таких пациентов имеют настоящую внегонадную герминогенную опухоль (СДМ III: 9). У всех молодых мужчин с опухолевым поражением надключичных, забрюшинных или медиастинальных лимфоузлов необходимо исключить герминогенную опухоль яичка (СДМ III: 8-11). Повышенные уровни альфа-фетопротеина (АФП) и/или бета-хорионического гонадотропина (ХГ) также свидетельствуют в пользу диагноза герминогенной опухоли яичка. При нормальных уровнях опухолевых маркеров и подозрении на опухоль яичка окончательный диагноз должен быть подтвержден биопсией опухоли. Такие гистологические варианты как низко- или недифференцированный рак или низкодифференцированная аденокарцинома крайне подозрительны в отношении возможной герминогенной опухоли яичка. В этом случае показано выполнение иммуногистохимического исследования со специфическими для герминогенной опухоли маркерами. Окончательно подтвердить либо отвергнуть диагноз позволяет определение характерной для герминогенной опухоли яичка экспрессии изохромосомы i(12p). Диагностические процедуры при первичной опухоли яичкаПри сборе анамнеза делается акцент на следующие факторы риска развития опухоли яичка: наличие в анамнезе опухоли контралатерального яичка (СДМ IIA: 12-14), крипторхизм (даже если он был ранее устранен) (СДМ IIA: 15-17, СДМ IIB: 18,19) и опухоль яичка у родственников первой степени родства, особенно отца или братьев (СДМ IIB: 20-22). Обязательными диагностическими процедурами (таблица 2) являются пальпация и определение опухолевых маркеров АФП и ХГ (СДМ IIA: 23-29). Важно определять именно бета-субъединицу ХГ, так как определение общего ХГ может иногда давать к ложно-положительный результат. Уровень лактатдегидрогеназы (ЛДГ) является важным прогностическим фактором и также должен быть известен до начала терапии. Нейрон-специфическая энолаза (НСЭ) и плацентарная щелочная фосфатаза (ПЩФ) в некоторых случаях также могут давать дополнительную информацию в процессе лечения и последующего наблюдения за больными с распространенной семиномой. Однако это не является обязательным исследованием. Информативность ПЩФ существенно снижается у курильщиков. Рутинное определение других маркеров (например, изоферментов ЛДГ) также не рекомендуется. При УЗИ мошонки следует использовать датчик 7,5 MHz (EBM IV: 23). Другие диагностические процедуры, такие как магнитно-резонансная томография (МРТ) или позитронно-эмиссионная томография (ПЭТ) не должны применяться рутинно, так как их результаты не влияют на тактику лечения больных. Таблица 2. Диагностика и стадирование герминогенных опухолей яичка.
Лечение первичной опухоли яичкаОрхофуникулэктомия Как правило, орхофуникулэктомия является первой лечебной процедурой (СДМ IIB: 30, 31). У больных в тяжелом состоянии, обусловленном метастатическим процессом, а также при высоком уровне АФП или ХГ показано начало химиотерапии по жизненным показаниям без морфологической верификации диагноза. В данной ситуации орхофуникулэктомия выполняется по окончании химиотерапии. Опухолевые маркеры необходимо определять перед орхофуникулэктомией и после нее (обычно через 7 дней) для оценки времени их полужизни (норма для АФП<7 дней, бета-ХГ<3 дней). Орхофуникулэктомия выполняется через паховый разрез (СДМ IIA: 32, СДМ IIB: 33, 34). Пораженное опухолью яичко удаляется вместе с семенным кантиком до уровня внутреннего пахового кольца. При нормальном уровне опухолевых маркеров и маленькой опухоли яичка необходимо выполнение срочной интраоперационной биопсии, чтобы определиться с объемом оперативного вмешательства (при доброкачественной опухоли можно ограничиться резекцией яичка) (СДМ IIB: 35, 36). Таблица 3: Лечение первичной опухоли яичка.
Органосохраняющие вмешательства Органосохраняющие вмешательства могут служить альтернативой орхофуникулэктомии при небольших опухолях яичка, однако данный подход является экспериментальным, и его применение возможно лишь в рамках научных исследований. В случае же с синхронными билатеральными опухолями яичек, метахронными контралатеральными опухолями или опухолями единственного яичка при нормальном уровне тестостерона органосохраняющие вмешательства являются альтернативой орхофуникулэктомии, что должно обсуждаться с пациентом. Органосохраняющие вмешательства должны выполняться только в центрах, имеющих опыт выполнения таких процедур (СДМ IIB: 37-39). Если в резецированном яичке обнаружена внутрипротоковая карцинома, то рекомендуется проведение адъювантной лучевой терапии на оставшуюся часть яичка, как это делается при внутрипротоковой карциноме единственного яичка (СДМ IIB: 14, 37-40). Диагностика и лечение внутрипротоковой карциномы (ВПК или carcinoma in situ) Биопсия яичка у больных с герминогенной опухолью яичка Внутрипротоковая карцинома является предраковым заболеванием. У пациентов с внутрипротоковой карциномы кумулятивный риск развития герминогенной опухоли яичка в течение 7 лет составляет 70% (СДМ IIB: 41). У 5% больных с герминогенной опухолью яичка в контрлатеральном «здоровом» яичке имеется внутрипротоковая карцинома, обнаруживаемая с помощью открытой биопсии в 99% случаев (таблица 4). В атрофичном яичке (объем <12 мл) в возрасте до 30 лет риск обнаружения внутрипротоковой карциномы составляет >34% (СДМ IIA: 14,40,42; СДМ IIB: 43). Таким образом, у пациентов с высоким риском развития внутрипротоковой карциномы должна обсуждаться биопсия контралатерального яичка (СДМ IIA: 14,40). Данная процедура выполняется одномоментно с орхофуникулэктомией. Биоптат для идентификации внутрипротоковой карциномы необходимо сохранять в растворе Stieve's и Bouin's (не в формалине!) (СДМ IIB: 44,45). Таблица 4. Частота развития и диагностика внутрипротоковой карциномы в яичке, не пораженном герминогенной опухолью.
Биопсия яичка у больных с внегонадной герминогенной опухолью Приблизительно у трети больных с внегонадной (забрюшинной) герминогенной опухолью в одном или обоих яичках при биопсии обнаруживается внутрипротоковая карцинома. Риск развития метахронной опухоли яичка у больного с внегонадной герминогенной опухолью в течение последующих 10 лет составляет около 10% и выше при несеминомных опухолях и забрюшинной локализации по сравнению с семиномой (1,4%) либо первичной опухолью средостения (6,2%) (СДМ III: 10). Однако, принимая во внимание то, что все пациенты с внегонадной герминогенной опухолью получают платиносодержащую химиотерапию, значительно снижающую частоту внутрипротоковой карциномы, рутинное выполнение двусторонней биопсии яичек не рекомендуется (таблица 4). Тем не менее, если у больного внегонадной герминогенной опухолью с высоким риском внутрипротоковой карциномы биопсия все же планируется, ее рекомендуется выполнять до начала химиотерапии (СДМ IIA: 23-29, СДМ III: 46,47; СДМ IV: 23). При планировании биопсии после химиотерапии ее следует выполнять не ранее, чем через 6 мес. после завершения лечения (СДМ IIA: 23-29, СДМ III: 46,47; СДМ IV: 23). Внутрипротоковая карцинома контралатерального яичка или поражение единственного яичка после органосохраняющего лечения Существуют три основные лечебные опции – орхофуникулэктомия, лучевая терапия и наблюдение – которые должны быть обсуждены с каждым пациентом. Орхофуникулэктомия и лучевая терапия позволяют окончательно вылечить, но ценой потери фертильности. Так как интервал между обнаружением внутрипротоковой карциномы и развитием опухоли яичка обычно долгий, для больных, желающих завести детей, можно предложить наблюдение. При этом необходимо регулярно выполнять УЗИ яичка. Лучевая терапия в дозе 20Гр (по 2Гр, 5 фракций в неделю) способна уничтожить все фокусы внутрипротоковой карциномы (СДМ III: 48-51). С целью сохранения продукции тестостерона исследовалась возможность снижения суммарной дозы до <20Гр. Не ясно, привело ли это к желаемому результату, однако была отмечена несколько меньшая частота полных эрадикаций внутрипротоковой карциномы (СДМ IIB: 52-54). После лучевой терапии необходим регулярный мониторинг уровня тестостерона, так как возможно повреждение функции клеток Лейдига (СДМ IIB: 53). Аналогичный мониторинг применим и для пациентов после органосохраняющей операции. Всем больным со сниженным уровнем тестостерона и клиническими признаками дефицита андрогенов должна быть предложена заместительная гормональная терапия. Таблица 5. Лечение внутрипротоковой карциномы (ВПК) яичка.
Лечение внутрипротоковой карциномы у больных без явной опухоли яичка Внутрипротоковая карцинома может быть обнаружена случайно при биопсии яичка по поводу неопухолевой патологии (бесплодие или внегонадная герминогенная опухоль). При нормальном контралатеральном яичке орхофуникулэктомия является оптимальной, так как при лучевой терапии возможно повреждение рассеянной радиацией здорового яичка с нарушением фертильности. В частности, это применимо для больных с опухолью яичка, развившемся в атрофичном яичке. Лечение внутрипротоковой карциномы у больных, которым планируется проведение химиотерапии Если у больного с внутрипротоковой карциномой планируется проведение химиотерапии, лучевая терапия должна быть отложена из-за высокого риска повреждения клеток Лейдига в результате комбинированного лечения. Более того, химиотерапия устраняет внутрипротоковую карциному у 2/3 таких больных (СДМ IIB: 52; СДМ III: 50,55). Поэтому повторная биопсия должна выполняться не ранее, чем через 6 мес. от завершения химиотерапии. Рекомендуется выполнять биопсию из двух участков, так как количество опухолевых клеток может уменьшиться в результате эффекта химиотерапии и вероятность «пропустить» их будет высока (СДМ IV: 56). Больным с персистирующей внутрипротоковой карциномой после химиотерапии лечение проводится по описанным выше принципам. Морфологическое исследование герминогенной опухоли яичкаДля морфологического исследования рекомендуется рассечение опухоли продольно. Дополнительно выполняются срезы с семенного канатика. Для полного гистологического исследования опухоли яичка необходимо приготовить один блок с каждого сантиметра опухоли (но не менее трех блоков с опухоли), а также блоки нормальной ткани яичка, прилегающей к опухоли. Следует также взять образцы семенного канатика на уровне резекции и отступя 1 см от яичка. Иммуногистохимическое исследование может включать определение цитокератина (обнаружение несеминомных элементов), плацентарной щелочной фосфатазы (обнаружение внутрипротоковой карциномы), CD31/фактора VIII (визуализация эндотелия сосудов), а также АФП и ХГ. Внутрипротоковая карцинома может быть определена с помощью окраски гематоксилин-эозином, определения плацентарной щелочной фосфатазы. Опухоль должна быть классифицирована в соответствии с классификацией ВОЗ (57, таблица 6). Категория «анапластическая семинома» в настоящее время не употребляется. В заключении патоморфолога должны быть отражены следующие показатели (таблица 7): локализация и размер опухоли яичка, мультицентричность, распространение опухоли (rete testis, tunica albuginea, tunica vaginalis, придаток, семенной канатик, кожа мошонки), категория рТ в соответствии с классификацией UICC (58), гистологический тип (ВОЗ-ICD-O), наличие или отсутствие внутрипротоковой карциномы, наличие или отсутствие инвазии в кровеносные или лимфатические сосуды (57). Если опухоль яичка представлена несколькими компонентами, то дается их количественное соотношение. Аналогично указывается присутствие клеток синцитиотрофобласта в семиноме и саркоматозные элементы в сперматоцитарной семиноме, как это рекомендовано ВОЗ. Морфологическое заключение крайне важно для правильного планирования лечения. Поэтому настоятельно рекомендуется привлекать для исследования всех гистологических препаратов патоморфолога, имеющего опыт работы с герминогенной опухолью. Таблица 6. Классификация ВОЗ герминогенных опухолей яичка (7).
Таблица 7. Патоморфологическое заключение по герминогенным опухолям яичка.
Стадирование и определение прогнозаДля определения клинической стадии заболевания у больного с герминогенной опухолью яичка используется классификация UICC по показателям TNM (58). Кроме того, для больных с метастатическим процессом определяется прогноз в соответствии с классификацией IGCCCG (59), которая также введена в классификацию TNM. Для выработки индивидуального плана лечения учитываются классификации TNM и IGCCCG. Последняя включает в себя ряд таких прогностических факторов как гистологическая форма, локализация первичной опухоли, локализация метастазов и уровни АФП, ХГ и ЛДГ. На их основе определяется прогноз пациента – «хороший», «промежуточный» или «неблагоприятный» (таблица 8). Для больных с внегонадными герминогенными опухолями была предложена другая прогностическая модель (11), однако в настоящее время она рутинно не применяется. Таблица 8. Классификация International Germ Cell Cancer Collaborative Group (59) (IGCCCG).
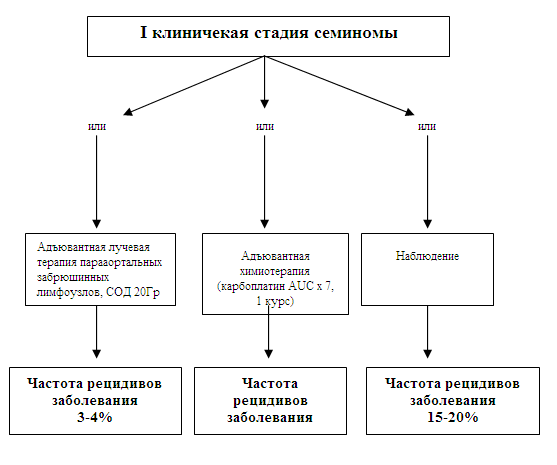
*ВГН – верхняя граница нормы Факторы прогноза при начальных стадиях заболеванияКлиническая I стадия семиномы Не смотря на то, что ни одна классификация не была протестирована в проспективных исследованиях, известно, что размер первичной опухоли яичка (<4 см и >=4 см) и инфильтрация rete testis являются независимыми прогностическими признаками, предсказывающими присутствие оккультных метастазов (СДМ IIB: 60). Эти патоморфологические показатели должны документироваться. Значение двух других показателей - возраст пациента (<34 и >=34 лет) и наличие сосудистой инвазии – остается противоречивым (СДМ IIB: 60-62, СДМ III: 62,63). Клиническая I стадия несеминомных герминогенных опухолей яичка Инфильтрация кровеносных или лимфатических сосудов первичной опухолью яичка является важнейшим неблагоприятным прогностическим признаком и поэтому должно быть оценено у всех пациентов (EBM IB: 64, EBM IIA: 65-69, EBM IIB: 70-73, EBM III: 73-80). Без адъювантного лечения у 48% больных с сосудистой инвазией в дальнейшем разовьется метастатический процесс, тогда как при отсутствии вовлечения сосудов – лишь у 14-22% (СДМ IIB: 72). Была показана также значимость пролиферативной активности опухоли яичка наряду с процентным содержанием в ней эмбрионального рака (СДМ IIB: 68,70,72,77, СДМ III: 75,76,78-82). Однако эти признаки не добавляют прогностической информации к сосудистой инвазии. Несеминомные герминогенные опухоли яичка: патологическая IIA/B стадия (PS) Если после забрюшинной лимфаденэктомии адъювантная химиотерапия не назначается (СДМ III: 83,84), то в данном случае независимыми прогностическими признаками рецидива заболевания являются размер удаленных забрюшинных лимфоузлов [<2 см (PS IIA) и 2-5 см (PS IIB)] и сосудистая инвазия в первичной опухоли яичка. Лучевая диагностика Различные методы лучевой диагностики не сравнивались в проспективных исследованиях III фазы, поэтому имеющиеся результаты сложно оценивать в градации СДМ (85). Компьютерная томография (КТ) органов грудной клетки, брюшной полости и малого таза с внутривенным и пероральным контрастированием является обязательной процедурой (86-91). КТ органов грудной клетки может не выполняться у больных семиномой яичка при отсутствии поражения забрюшинных лимфоузлов. В оценке состояния легких и средостения КТ является более чувствительным методом, чем обыкновенная рентгенография (90-92). Однако при этом повышается частота ложно-положительных результатов при обнаружении легочных/плевральных узлов <1 см (78,88,90-93). Кроме того, частота ложно-негативных результатов при КТ брюшной полости и малого таза может достигать 30%, что не позволяет надежно дифференцировать между собой клинические I и IIA стадии (87-89,94,95). В заключении лучевой диагностики детально описываются локализация, число и размер лимфоузлов. Ультразвуковое исследование (УЗИ) уступает КТ в оценке забрюшинного пространства (87). Магнитно-резонансная томография (МРТ) органов брюшной полости и малого таза не добавляет информации к КТ, и ее применение должно быть ограничено больными с непереносимостью йодсодержащих контрастов (96,97). В настоящее время нет однозначных данных, свидетельствующих о большей чувствительности позитронно-эмиссионной томографии (ПЭТ) по сравнению с КТ (98). Поэтому использование ПЭТ с целью стадирования вне рамок научных исследований не рекомендуется (99-104). Радиоизотопная сцинтиграфия костей скелета выполняется у больных с повышенным уровнем щелочной фосфатазы или клинической картиной костных метастазов. КТ (предпочтительнее МРТ) головного мозга показана при соответствующих симптомах (СДМ IV: 105,106). Вероятность метастатического поражения головного мозга повышается у больных с метастатической болезнью «промежуточного» и «неблагоприятного» прогноза по IGCCCG (59). Связанные с лечением аспекты фертильности и сохранения спермы У больных репродуктивного возраста перед началом лечения необходимо оценить их фертильность, что включает в себя определение общего уровня тестостерона, лютеинизирующего и фолликулостимулирующего гормонов и спермограммы. Пациенты должны быть проинформированы о возможности криопрезервации спермы. В идеале, эта процедура выполняется перед орхофуникулэктомией (СДМ II: 53, СДМ III: 51,107,108, СДМ IV: 109-111). В случае двусторонних опухолей яичка или опухоли одного яичка с внутрипротоковой карциномой в другом и выраженной олиго-, азо- или аспермией может быть полезна экстракция спермы (СДМ IV: 111-116). Однако эта процедура доступна не во всех европейских странах. Заместительная гормональная терапия У больных с двусторонней орхофуникулэктомией пожизненно должна проводиться заместительная терапия тестостероном. После односторонней орхофуникулэктомии показанием к назначению препаратов тестостерона является его низкий уровень в сыворотке и соответствующие клинические симптомы (СДМ I-IV: 117). Контрацепция Не смотря на то, что нет данных о повышении частоты уродств у детей, рожденных после окончания лечения, рекомендуется надежная контрацепция в процессе терапии и в течение последующего года наблюдения (СДМ III: 118). У больных, желающих завести детей, необходимо контролировать уровни гормонов и показатели спермограммы на протяжении 1-3 лет после завершения лечения. Лечение больных с I клинической стадией семиномыНе смотря на отсутствие после орхофуникулэктомии других проявлений болезни по данным КТ, при отсутствии адъювантной терапии у 20% больных в дальнейшем наблюдается метастазирование (СДМ IIB: 60,119,120). При этом длительная выживаемость пациентов с I клинической стадией семиномы составляет практически 100%, что может быть достигнуто тремя подходами: адъювантная лучевая терапия, наблюдение (при рецидиве проводится лучевая терапия или химиотерапия) или адъювантная химиотерапия карбоплатином (СДМ IIB: 121-123). Если первые два варианта давно стали стандартными, то эффективность одного цикла адъювантной химиотерапии карбоплатином была показана лишь в одном проспективном рандомизированном исследовании (СДМ IB: 123a). Адъювантная лучевая терапия в настоящее время применяется наиболее часто, снижая риск прогрессирования заболевания до 3-4%. Практически все рецидивы локализуются вне полей облучения, в основном в малом тазу (1,7%) или на границе полей (СДМ IB: 124,125, СДМ IIA: 126,127). Лучевая терапия проводится на поддиафрагмальные и парааортальные/паракавальные лимфоузлы (СДМ IB: 124,125, СДМ IIA: 126,127). Верхней и нижней границами облучения являются верхний край Th11 и нижний край L5 соответственно. На стороне пораженного яичка латеральной границей является почечная ножка, а с контралатеральной стороны – поперечные отростки поясничных позвонков. Суммарная доза 20Гр подводится по 2Гр/5 дней в неделю. В недавно завершенном проспективном рандомизированном исследовании Medical Research Council (MRC) была продемонстрирована равная эффективность 20Гр и 30Гр (СДМ IB: 125). Обязательным является применение линейного ускорителя. Расширение полей облучения на ипсилатеральные подвздошные, паховые лимфоузлы и мошонку при опухоли неспустившегося яичка или рТ3/4 опухоли, вероятнее всего, не показано, так как это не улучшает отдаленные результаты лечения (СДМ IIA: 32, СДМ III: 128). Ограничение объемов и доз облучения в программах современной адъювантной лучевой терапии существенно снизило частоту лучевого поражения здорового яичка (СДМIB: 124; СДМ IIB: 129). В настоящее время рассеянная доза радиации на контралатеральное яичко составляет <2Гр, что не требует его экранирования (СДМ IB: 124, СДМ IIB: 129). Адъювантная лучевая терапия может сопровождаться слабо выраженными острыми реакциями (обычно I – II степени по шкале ВОЗ), главным образом, в виде гастроинтестинальных симптомов (СДМ IIB: 126).Прогрессирование заболевания после лучевой терапии наблюдается у 3-4% пациентов, локализуясь практически всегда вне полей облучения (СДМ IB: 120, СДМ IIA: 126, СДМ IIB: 130,131). Около 80% больных получают адъювантную лучевую терапию напрасно, так как и без лечения у них в дальнейшем не разовьется рецидив. Кроме того, при сравнении с группой наблюдения было выявлено незначительное увеличение риска вторичных опухолей после облучения (СДМ III: 132-134). Однако в настоящее время нет достаточных данных, свидетельствующих об увеличении риска вторичных опухолей при проведении современной лучевой терапии с меньшими дозами и полями облучения. Риск лучевого нарушения фертильности при этом дискутабелен (СДМ III: 51,107). Динамическое наблюдение за больными после орхофуникулэктомии является альтернативой адъювантной лучевой терапии (СДМ IIA: 126,127, СДМ IIB: 130,131). Обоснованием данного подхода является тот факт, что и без всякого лечения у 80-85% больных не разовьется прогрессирование болезни, и они, таким образом, будут напрасно получать лучевую терапию. По данным ретроспективного метаанализа негативными прогностическими факторами рецидива заболевания у больных, наблюдавшихся после удаления первичной опухоли яичка, были размер опухоли яичка ?4 см и ее инвазия в rete testis (СДМ IIB: 60, СДМ III: 135). 97% всех случаев прогрессирования развивается в забрюшинных или верхних подвздошных лимфоузлах (СДМ IIB: 61,120,136,137) и может иметь место даже через 10 и более лет (СДМ IIB: 61,120, СДМ III: 138). Это диктует необходимость более длительного мониторинга за больными. Лечение больных с рецидивом заболевания обычно является более интенсивным (СДМ IIB: 119, СДМ III: 138). Из-за большего риска рецидива заболевания некоторые пациенты могут испытывать постоянный психологический стресс (СДМ III: 139). Другой альтернативой является адъювантная химиотерапия в виде одного курса карбоплатином AUC х 7. В большом рандомизированном исследовании MRC/EORTC проведено сравнение эффективности адъювантной лучевой терапии с монотерапией карбоплатином AUC=7. При среднем сроке наблюдения 4 года не было выявлено различий в частоте рецидивов заболевания, времени до прогрессирования и выживаемости (СДМ IB: 123a). Локализация рецидивов была различной в зависимости от типа лечения: в забрюшинном пространстве - чаще в группе карбоплатина, в тазовых лимфоузлах – чаще после лучевой терапии. Преимуществом карбоплатина в сравнении с лучевой терапией была меньшая продолжительность лечения и снижение частоты рака контралатерального яичка (2 и 10 пациентов). Таким образом, несмотря на различия в частоте развития прогрессирования (3-4% после облучения или химиотерапии карбоплатином в сравнении с 15-20% при наблюдении), длительная общая выживаемость составляет почти 100%. Все три подхода являются в настоящее время стандартными в адъювантной терапии I клинической стадии семиномы (схема 1). Индивидуальный подход возможен на основе факторов риска, приводимых Warde (60), однако такая тактика – адъювантная терапия для группы высокого риска и наблюдение при низком риске – в настоящее время изучается в проспективном рандомизированном исследовании и не может пока быть рекомендована для рутинного применения. Схема 1. Алгоритм лечения больных семиномой I стадии после орхофуникулэктомии.
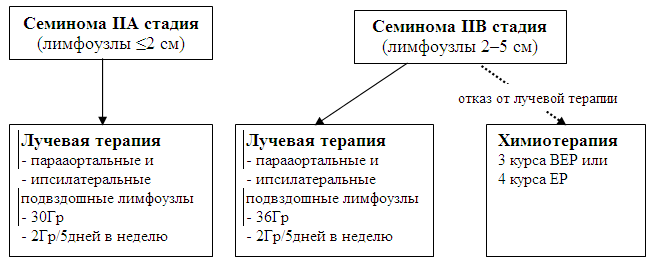
Лечение больных семиномой IIA/B клинической стадииСтандартом лечения IIA/B стадии семиномы является лучевая терапия. При использовании современной техники 6-летняя безрецидивная выживаемость составляет 95% для стадии IIA и 89% для стадии IIB (СДМ IIB: 140). Общая выживаемость при этом близка к 100% (СДМ IIB: 140-142, СДМ III: 142,143). Поля облучения включают в себя парааортальные и ипсилатеральные подвздошные лимфоузлы. Верхней границей поля является верхняя замыкательная пластинка тела Th11, нижней – верхняя граница вертлужной впадины. Во IIA стадии боковые границы облучения соответствуют стандартам I стадии. При IIB стадии латеральные границы определяются индивидуально, отступая от узла на 1,0–1,5 см. Лучевая терапия проводится в режиме стандартного фракционирования (по 2Гр/5 дней в неделю) до суммарной дозы 30Гр при IIA стадии и 36Гр при IIB стадии. Для снижения риска повреждения рассеянной радиацией оставшегося яичка, оно обязательно экранируется. Через 3 мес. после лучевой терапии выполняется КТ брюшной полости и малого таза для оценки эффекта (СДМ IIB: 144, СДМ III: 145-149); данные этого обследования являются также основой для дальнейшего наблюдения. Расширение полей облучения на контралатеральные подвздошные и паховые лимфоузлы не показано, так как нет данных, демонстрирующих преимущества данного подхода (СДМ IIA: 32, СДМ III: 143). Роль конкурентной химиолучевой терапии в настоящее время изучается (СДМ IIB: 142,150) и не может пока применяться вне рамок клинических исследований. Для пациентов с большими (N2) узлами, а также лиц, отказывающихся от проведения лучевой терапии, альтернативой является проведение 3 курсов химиотерапии стандартной комбинацией ВЕР (блеоцин, этопозид, цисплатин) или 4 курсов комбинацией ЕР (схема 2). Монотерапия карбоплатином даже в дозе AUC х 7 не показана в связи с большей частотой местных и отдаленных рецидивов заболевания (СДМ IIB: 151). Схема 2. Алгоритм лечения при IIA/B стадии семиномы
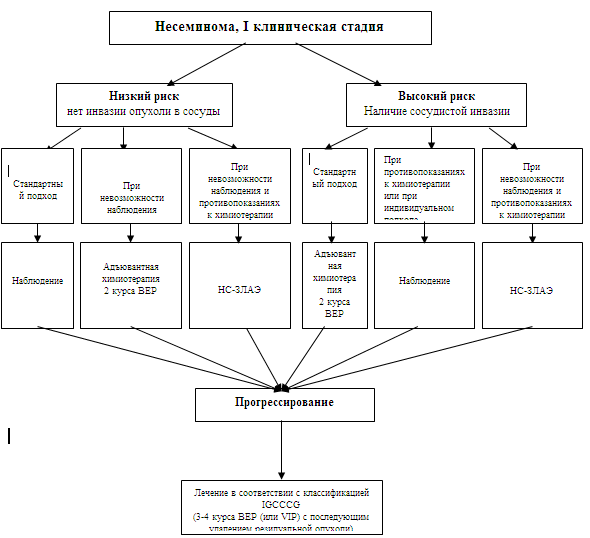
Лечение больных несеминомой I клинической стадииДлительная выживаемость больных несеминомой с I клинической стадией составляет 99% независимо от тактики лечения при условии правильного его проведения (СДМ IIB: 72,152). При наблюдении после орхофуникулэктомии частота рецидивов составляет 27-30% в сроки до 20 лет (EBM IIB: 77,152) (хотя 96% рецидивов реализуется в первые 2 года наблюдения). Метастазирование чаще всего возникает в забрюшинном пространстве (54-78%), реже в легких (13-31%), поражение более чем одного висцерального органа крайне редко (СДМ IIB: 152, СДМ III: 153). Сосудистая инвазия в первичной опухоли яичка является наиболее важным прогностическим признаком. При ее наличии риск метастазирования достигает 48% (СДМ IB: 64, СДМ IIB: 72) в сравнении с 14-22% при ее отсутствии (СДМ IB: 64, СДМ IIA: 66, СДМ IIB: 68,77). Поэтому выбор тактики лечения пациентов с I стадией основывается, прежде всего, на этом признаке (схема 3). Больные с низким риском рецидива заболевания (без сосудистой инвазии) должны наблюдаться, хотя стандартных рекомендаций по наблюдению пока не существует. При этом подходе 78-86% пациентам после орхофуникулэктомии не потребуется дальнейшее лечение (СДМ IIA: 66, СДМ IIB: 68,77). В случае прогрессирования заболевания назначение химиотерапии приводит к выздоровлению практически 100% больных. Если существуют обстоятельства, мешающие организации наблюдения (отдаленное место жительство, характерологические особенности пациента и др.), то рекомендуется проведение 2 курсов химиотерапии по программе ВЕР. Нерво-сберегающая забрюшинная лимфаденэктомия (НС-ЗЛАЭ) является альтернативой первым двум вариантам при противопоказаниях к их проведению. Для больных с высоким риском рецидива (наличие сосудистой инвазии) должен быть рассмотрен вопрос о проведении 2 курсов адъювантной химиотерапии по программе ВЕР. При этом подходе длительная безрецидивная и общая выживаемости составляют 97% и >=99% соответственно (СДМ IIB: 72). Недостатком адъювантной химиотерапии в данном случае является то, что половина больных с высоким риском напрасно получат химиотерапию с сопутствующей ей токсичностью (СДМ IB: 154, СДМ IIA: 155, СДМ III: 156,157), а также возможным нарушением фертильности (СДМ IIB: 158, СДМ III: 159) и потенциальным риском развития вторичных опухолей, что имеет место при больших дозах химиопрепаратов (EBM III: 107,132-134). С другой стороны, при наблюдении за пациентами высокого риска часть из них испытывают сильный психологический стресс (СДМ III: 139). Рецидивы могут развиться через много лет, и последующее лечение может быть более интенсивным. Тем не менее, если наблюдение проводится правильно, >98% рецидивов будут относиться к хорошему прогнозу и будут вылечены химиотерапией. Для тех немногих больных, нежелающих подвергаться адъювантной химиотерапии или наблюдению, можно предложить нерво-сберегающую забрюшинную лимфаденэктомию (НС-ЗЛАЭ) (СДМ IIA: 160, СДМ III: 161,162). Однако следует помнить, что около 50% пациентов напрасно подвергнутся операции и связанным с нею побочным эффектам (СДМ IIB: 152), в частности, с 6-8%-ным риском развития ретроградной эякуляции (СДМ IIB: 152, СДМ III: 163,164). Прогрессирование заболевания после НЗ-ЛАЭ наблюдается у ~10% больных, в основном, за счет развития метастазов в легких. Поздние рецидивы редки (СДМ III: 138). Схема 3: Тактика лечения больных с I стадией несеминомными герминогенными опухолями яичка после орхофуникулэктомии в зависимости от степени риска.
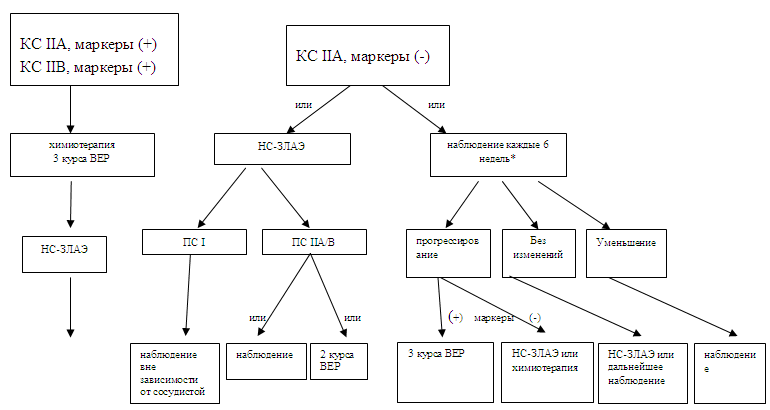
Лечение больных несеминомными герминогенными опухолями яичка с клиническими IIA/B стадиямиПри клинических IIA/B стадиях вылечиваются около 98% пациентов. Больные со IIA/B стадиями и повышенными уровнями АФП, ХГ и/или ЛДГ должны получать химиотерапию как при распространенном процессе в соответствии с рекомендациями IGCCCG (59). Выбор лечения для пациентов с нормальными уровнями опухолевых маркеров и небольшими забрюшинными лимфоузлами (1-2 см), подозрительными в отношении IIA стадии, всегда представляет собой некоторую проблему. Возможно два подхода: первый - ЗЛАЭ с диагностической и лечебной целями, что позволяет сразу же уточнить стадию, и второй - наблюдение с короткими (около 6 нед.) интервалами. Рост узла будет свидетельствовать о присутствии злокачественной опухоли, тогда как уменьшение – о его неопухолевой природе (схема 4). ЗЛАЭ следует выполнять с применением нерво-сберегающей техники (СДМ III: 165). Однако даже после НС-ЗЛАЭ, в зависимости от опыта хирурга, 5-32% больных теряют антероградную эякуляцию (СДМ IIA: 166, СДМ III: 155,157,159). До 10% пациентов имеют и другие послеоперационные осложнения (СДМ III: 164). После профилактической ЗЛАЭ у 12-13% не обнаруживается поражения забрюшинных лимфоузлов, т.е. имеет место патоморфологическая I стадия (ПС) (СДМ IIA: 166). В случае ПС IIA/B возможно проведение адъювантной химиотерапии или наблюдение (СДМ IB: 167, СДМ IIA: 168, СДМ III: 169,170). После химиотерапии рецидивы развиваются у 0–7% пациентов. При этом подавляющее большинство рецидивов реализуется вне забрюшинного пространства (СДМ IB: 167, СДМ IIA: 166, СДМ III: 161,170). Однако в проведении адъювантной химиотерапии в действительности нуждаются только 30% и 50% больных с ПС IIA и ПС IIB стадиями соответственно (СДМ IB: 167, СДМ IIA: 168, СДМ III: 161,169,170). Вследствие этого назначение химиотерапии всем пациентам с ПС II является неоправданным в 50-70% случаев, и будет сопровождаться острой и, возможно, отсроченной токсичностью (СДМ IB: 154, СДМ IIA: 171, СДМ IIB: 158, СДМ III: 132-134,154,172). Помочь в стадировании больных с клинической IIA/B стадией (КС) может биопсия увеличенных забрюшинных лимфоузлов под контролем УЗИ. При обнаружении злокачественной опухоли методом выбора является проведение 3 курсов химиотерапии ВЕР. Альтернативой ЗЛАЭ в лечении пациентов с КС IIA является наблюдение (схема 4). При прогрессировании заболевания без роста уровня АФП или ХГ показано оперативное лечение. При росте АФП или ХГ показано проведение химиотерапии по программе ВЕР в соответствии с прогнозом по IGCCCG (СДМ IIA: 166; СДМ III: 173-175). Ценность ПЭТ в такой ситуации еще не установлена. Схема 4. Алгоритм лечения больных несеминомой с клинической IIA стадии.
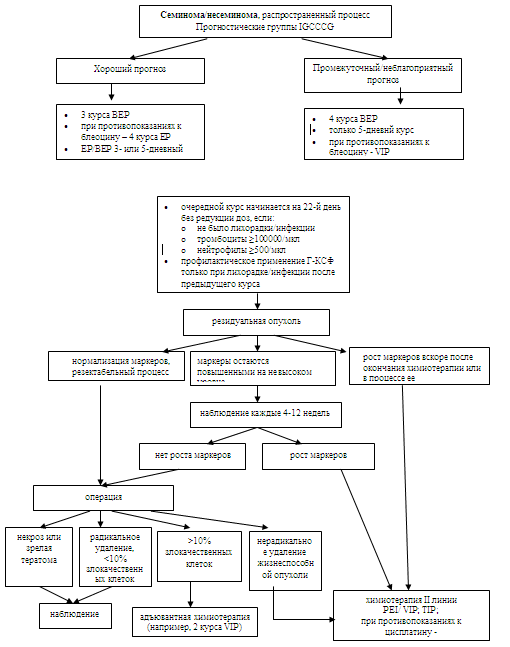
Лечение больных распространенными герминогенными опухолями яичкаСтандартным лечением больных с «хорошим» прогнозом по критериям IGCCCG (59) являются 3 курса химиотерапии по программе ВЕР. При противопоказаниях к применению блеомицина возможно применение 4 курсов ЕР (EBM IA: 59, EBM IB: 176,177, EBM IIA: 178, EBM III: 179). По эффективности 5-дневный «классический» ВЕР (этопозид 100 мг/м2 и цисплатин 20 мг/м2 1-5 дни) равнозначен 3-дневному (этопозид 165 мг/м2 1-3 дни и цисплатин 50 мг/м2 1,2 дни) (EBM IB: 180). Однако 4 курса 3-дневного ВЕР обладают большей отсроченной токсичностью, включая ототоксичность, периферическую нейропатию и синдром Рейно (EBM IB: 181,182, EBM IIA: 178). Поэтому 4 курса «классического» 5-дневного ВЕР остаются стандартным лечением больных с «промежуточным» и «неблагоприятным» прогнозом. Очередной курс химиотерапии должен начинаться на 22-й день без редукций доз. Отложить его начало можно не более чем на 3 дня при сохраняющейся лихорадке, нейтропении <500/мкл или тромбоцитопении <100.000/мкл к первому дню очередного курса. Обычно не возникает необходимости в профилактическом применении ростовых факторов, в частности гранулоцитарного колониестимулирующего (Г-КСФ). Но если после предыдущего курса имели место серьезное инфекционное осложнение или необходимость в редукции доз из-за нейтропении, показано профилактическое применение Г-КСФ (EBM IIA: 183,184). В соответствии с классификацией IGCCCG 5-летняя выживаемость больных «промежуточной» группы составляет 80%. Результаты мета анализа поддерживают 4 курса ВЕР как стандартное лечение для этих пациентов (EBM IA: 59, EBM IB: 181). Для поиска более эффективного лечения все пациенты «промежуточного» прогноза должны участвовать в проспективных исследованиях (EBM IV: 185). Для больных «неблагоприятной» прогностической группы 4 курса ВЕР также являются стандартным лечением. 4 курса VIP (этопозид, ифосфамид и цисплатин) по эффективности равны ВЕР, но обладают большей острой миелотоксичностью и поэтому не могут рекомендоваться в качестве стандартной терапии (EBM IB: 186). В анализе IGCCCG 5-летняя безрецидивная и общая выживаемости составили 41% и 48% соответственно. Для отдельных пациентов, желающих избежать легочной блеоциновой токсичности (из-за уже существующего пневмосклероза или особенностей профессии), альтернативой ВЕР является режим VIP. Больным в исходно неудовлетворительном общем состоянии (статус Карновского <50%), с обширным поражением печени, легких или ЦНС возможно назначение укороченного первого курса химиотерапии (например, 2-3 дня цисплатин/этопозид), а после улучшения состояния проведение лечения в полных дозах. До сих пор не показано, что высокодозная химиотерапия с поддержкой аутологичными стволовыми клетками в качестве первой линии улучшает выживаемость. Поэтому она не должна применяться вне рамок проспективных клинических исследований (EBM IIB: 187,188, EBM III: 189). Для достижения наилучших результатов лечения при «неблагоприятном» прогнозе пациенты должны переводиться в специализированные центры с немедленным началом терапии (EBM III: 1). Схема 5. Алгоритм лечения при распространенных герминогенных опухолях яичка
Таблица 9. Режимы химиотерапии, применяемые в лечении герминогенных опухолей яичка
Лечение больных с метастазами в головной мозгМетастазы в головной мозг имеют место у ~10% всех больных с распространенными герминогенными опухолями яичка (т.е. у 1-2% от всех больных раком яичка). При рецидиве заболевания поражение ЦНС обычно является частью системного прогрессирования и очень редко бывает изолированным после проведенного ранее успешного лечения. Пациенты, у которых метастазы в головной мозг выявлены при первичном обращении, имеют длительную выживаемость в 30-40% случаев. Если же метастазы в головной мозг развиваются в процессе первой линии химиотерапии или как часть системного рецидива, то 5-летняя выживаемость не превышает 2-5%. Наилучший прогноз имеют больные с солитарным метастазом в головной мозг до начала лечения (СДМ III: 105,106). Метастатическая хориокарцинома является прогностически неблагоприятной независимо от программы лечения (неопубликованные результаты GTCSG CNS Working Party) (СДМ III: 105,106,190). Оптимальная последовательность терапии (химиотерапия, лучевая терапия, хирургия) еще окончательно не определена. Проведение химиотерапии обязательно для всех пациентов с поражением ЦНС (EBM III: 190). Недавно выполненный многофакторный анализ, в отличие от предыдущих негативных сообщений (СДМ III: 106), показал, что добавление лучевой терапии на головной мозг к системной химиотерапии улучшает общую выживаемость (СДM III: 191). Не выяснена также роль облучения головного мозга после достижения полного эффекта в результате одной химиотерапии. Поэтому лучевая терапия должна применяться только в рамках контролируемых клинических исследований в соответствии с процедурами, принятыми при других солидных опухолях, например облучение всего головного мозга (разовая доза не более 2Гр) одновременно с цисплатин-содержащей химиотерапией (СДМ IIB: 192). Остается не ясным, требуется ли хирургически удалять солитарные резидуальные метастазы после химиотерапии (выполнение МРТ обязательно для обнаружения микрометастазов). Решение зависит от распространенности процесса, локализации очага и морфологии первичной опухоли. Тем нее менее, вопрос об оперативном лечении может рассматриваться у отдельных больных с солитарными метастазами в головной мозг. Мониторинг эффекта терапии и дальнейшее лечениеПрогностическое значение роста уровня опухолевых маркеров в самом начале химиотерапии первой линии, так же как и их замедленное снижение в процессе ее остается неоднозначным (СДМ III: 193). В случае медленного падения уровня маркеров на фоне достигнутого (радиологически оцененного) эффекта или стабилизации показано проведение химиотерапии в полном объеме, т.е. 3-4 курса в зависимости от прогноза IGCCCG (СДМ IIA: 59,194,195). При росте маркеров в процессе химиотерапии, независимо от результатов радиологического исследования, необходимо начало химиотерапии второй линии. Крайне важно определять уровень маркеров перед каждым курсом. В противном случае их рост в начале лечения, обусловленный выходом из распадающихся опухолевых клеток, может быть ошибочно расценен как прогрессирование (схема 5). При сохраняющихся повышенными на невысоком уровне опухолевых маркерах после четырех курсов ВЕР или VIP показано частое наблюдение. Вся резидуальная опухоль должна быть, по возможности, удалена (СДМ III: 196). Начало химиотерапии возможно лишь в случае однозначного роста уровня маркеров (схема 5). Мониторинг маркеров обязателен перед каждым курсом терапии. Радиологическая оценка эффекта производится после завершения первой линии химиотерапии. У больных с медленным снижением уровня опухолевых маркеров или клиническими признаками прогрессирования радиологическое обследование проводится раньше. Если прогрессирование опухоли не вызывает сомнения, то необходима ранняя модификация первой линии. Прогрессирование с ростом уровня маркеров на фоне первой линии химиотерапии требует немедленного начала химиотерапии рецидива (СДМ IIB: 188,197). Следует помнить, что пациенты с маркерным прогрессированием на протяжении или в течение 4 недель после завершения цисплатин-содержащей химиотерапии имеют крайне неблагоприятный прогноз (СДМ IIB: 198). Если на фоне снижающихся опухолевых маркеров отмечается рост метастазов, то, чаще всего, это является проявлением синдрома «растущей зрелой тератомы». В данной ситуации показано завершение всего запланированного объема химиотерапии с последующим удалением резидуальной опухоли. Лишь в случае быстрого роста опухоли возможно немедленное выполнение операции до завершения индукционной химиотерапии (СДМ IV). После окончания химиотерапии первой линии удаление остаточной опухоли показано также пациентам с сохраняющимися повышенными на невысоком уровне опухолевыми маркерами. Химиотерапия рецидива необходима при росте уровня маркеров после первой линии терапии (СДМ III: 182). Удаление резидуальной опухолиСеминома У больных семиномой резидуальная опухоль после химио- или лучевой терапии не требует удаления независимо от размеров. При этом необходимы частые обследования с определением маркеров (СДМ IIB: 200; СДМ III: 201-204). Положительные результаты ПЭТ, выполненной по прошествии 4 и более недель после завершения химиолучевой терапии, у пациентов с остаточными очагами >3 см являются надежным признаком наличия жизнеспособной опухоли (СДМ IIB: 205, 206). При росте резидуальной опухоли после первой линии химиотерапии показано морфологическое подтверждение диагноза семиномы с последующим началом химиотерапии второй линии (СДМ III: 207, СДМ IV: 208). Несеминомные герминогенные опухоли яичка Больные, достигшие полного эффекта (нормальные уровни опухолевых маркеров и остаточные метастазы <=1 см) по завершении химиотерапии, в оперативном лечении не нуждаются (СДМ IIB: 209, 210, СДМ III: 211). Если же маркеры нормализовались, и размеры резидуальной опухоли превышают 1 см, то последняя должна быть оперативно удалена (СДМ IIA: 221,222, СДМ IIB: 223, СДМ III: 211,224,225). Морфологически в резецированной опухоли приблизительно в 35%, 50% и 15% случаях обнаруживается соответственно некроз, зрелая тератома и злокачественная опухоль. После химиотерапии рецидива шанс обнаружения злокачественной опухоли повышается. По возможности удаляются все остающиеся проявления болезни. У больных с поражением нескольких анатомических областей вопрос об объеме оперативного вмешательства решается индивидуально (СДМ III: 196). При этом учитываются число и локализация очагов, риск рецидива и качество жизни (СДМ IIA: 222, СДМ III: 215). Возможность удаления очагов вне забрюшинного пространства и легких рассматривается индивидуально с учетом того, что различия в морфологии очагов из разных анатомических областей имеют место у 35-50% пациентов (EBM III: 217,226). Если в резецированной на первом этапе резидуальной опухоли обнаруживается лишь некроз, то возможно как наблюдение за остающимися проявлениями болезни, так и их удаление. Вследствие высокой частоты осложнений такие вмешательства должны выполняться только в специализированных центрах. Постхимиотерапевтическая лапароскопическая ЗЛАЭ остается исследовательской и не должна применяться вне рамок клинических исследований (СДМ III: 227-229). Консолидирующая химиотерапия после циторедуктивных вмешательств При наличии в удаленной резидуальной опухоли лишь некроза или зрелой тератомы дальнейшее лечение не показано. При обнаружении злокачественной опухоли или незрелой тератомы роль консолидирующей химиотерапии окончательно не определена. Ретроспективный анализ показал, что ее проведение улучшает лишь безрецидивную выживаемость. Поэтому в таких случаях вполне оправданной является тактика наблюдения (СДМ III: 230). Пациенты «хорошей» прогностической группы по IGCCCG в случае радикального удаления резидуальной опухоли при содержании <10% злокачественных клеток имеют благоприятный прогноз независимо от проведения адъювантной химиотерапии. В случае сомнительной радикальности вмешательства или при наличии >10% злокачественных клеток возможно проведение консолидирующей химиотерапии (2 курса индукционной или альтернативной химиотерапии – 2 ЕР или 2 VIP соответственно). У больных с резецированной жизнеспособной опухолью после второй или третьей линий химиотерапии прогноз значительно хуже. Адъювантная химиотерапия не улучшает выживаемость у таких больных и поэтому не показана (СДМ III: 218,224). Химиотерапия рецидивовПрогностическими факторами при рецидиве/прогрессировании заболевания являются локализация и морфология первичной опухоли, эффект первой линии терапии, продолжительность времени до прогрессирования и уровни АФП и ХГ на момент рецидива (СДМ IIB: 198, СДМ III: 193). Семинома При рецидиве заболевания после лучевой терапии тактика и прогноз не отличаются от исходно диссеминированных случаев. Применение химиотерапии на основе цисплатина излечивает >90% таких пациентов (схема 1). Если же рецидив заболевания развился у больных, получавших ВЕР, то проведение цисплатин-содержащей химиотерапии второй линии приводит к длительной выживаемости у <=50% больных (СДМ IIB: 231). Режимами выбора в данной ситуации являются 4 курса PEI или VIP (этопозид, ифосфамид и цисплатин), VeIP (винбластин, ифосфамид и цисплатин) или TIP (паклитаксел, ифосфамид и цисплатин) (СДМ IIB: 232). По-видимому, все эти режимы обладают схожей эффективностью (СДМ IIB: 233,234). Неизвестно также, обладает ли высокодозная химиотерапия преимуществом перед стандартной (СДМ IIB: 235). Поэтому пациенты с рецидивами семиномы должны получать лечение в специализированных центрах, участвуя в проспективных рандомизированных исследованиях. Несеминомные опухоли яичка Больные с рецидивом заболевания после одной орхофуникулэктомии имеют длительную выживаемость >90% и должны получать химиотерапию на основе цисплатина, как это принято при распространенных несеминомных герминогенных опухолях яичка. При рецидиве заболевания после первой линии химиотерапии показано проведение 4 курсов по программе PEI (VIP), VeIP или TIP. Режим TIP представляется перспективным, так как паклитаксел показал активность как в монотерапии, так и в комбинации с ифосфамидом и цисплатином (СДМ IIB: 232). Химиотерапия рецидива в стандартных дозах излечивает 15-40% пациентов в зависимости от факторов риска (СДМ IIB: 198,233, СДМ III: 193). Ни один из режимов не показал своего явного преимущества над другим (СДМ IIB: 233,234). Применение в комбинации более трех препаратов усиливает токсичность без улучшения отдаленных результатов лечения (СДМ IIB: 234,236). В силу присутствия неблагоприятных прогностических факторов результаты химиотерапии второй линии, в целом, остаются неудовлетворительными (СДМ IIB 198, СДМ III: 193). В исследованиях II фазы показано улучшение выживаемости на 10% при использовании высокодозной химиотерапии (ВДХ) (СДМ IIB: 235). Однако в большом рандомизированном исследовании ВДХ не улучшила выживаемость в сравнении со стандартной химиотерапией (СДМ IB: 237). Поэтому все пациенты с рецидивами должны включаться в текущие многоцентровые исследования и получать терапию в специализированных центрах. В качестве третьей линии химиотерапии возможно применение следующих режимов химиотерапии: паклитаксел-гемцитабин, гемцитабин-оксалиплатин или паклитаксел-гемцитабин-цисплатин, желательно в рамках клинических исследований. Хирургия рецидивовРезидуальная опухоль после химиотерапии рецидива должна быть резецирована в течение 4-6 недель после нормализации маркеров или персистенции маркеров на невысоком уровне. Лишь при прогрессировании заболевания после химиотерапии рецидива и отсутствии других вариантов лекарственной терапии возможна попытка оперативного лечения при условии возможности безопасного радикального удаления всех проявлений болезни. Этот подход позволяет достичь длительной выживаемости у 25% больных (СДМ III: 198,238-243), в частности при поздних рецидивах, умеренно повышенном уровне АФП и локализованной (в основном, забрюшинной) опухоли. При быстром прогрессировании болезни со стремительно растущим уровнем ХГ хирургия рецидива бессмысленна. Поздние рецидивы (>=2 лет после окончания первой линии терапии)При технической возможности пациенты с поздним рецидивом и отрицательными опухолевыми маркерами должны подвергаться оперативному лечению с целью радикального удаления зрелой тератомы или вторичной негерминогенной опухоли. Так как чувствительность поздних рецидивов к химиотерапии мала, при небольших и резектабельных очагах даже в случае повышенных маркеров показано выполнение операции (EBM III: 138,244). Если же выполнение радикального вмешательства невозможно, выполняется биопсия, по результатам которой начинается химиотерапии рецидива. При ответе опухоли на химиотерапию всегда должен быть рассмотрен вопрос о повторной циторедуктивной операции. При исчерпанности возможностей химиотерапии при нерезектабельной, но локализованной опухоли возможно назначение лучевой терапии. НаблюдениеНаблюдение больных с герминогенными опухолями яичка включает в себя регулярные клинические осмотры, контроль опухолевых маркеров и лучевые диагностические исследования. Врачи и пациенты должны всегда помнить о возможности развития опухоли контралатерального яичка. Если больной не получал химиотерапию, то этот риск составляет до 5%, тогда как ее проведение снижает его до 1-3%. Если при биопсии контралатерального яичка была выявлена внутрипротоковая карцинома, то без лечения вероятность развития герминогенной опухоли в течение 7 лет достигает 70% (СДМ IIB: 41). Все повторные опухоли яичка должны выявляться на ранней стадии путем регулярного контроля, в том числе и самим пациентом. Следует помнить, что после химиотерапии при УЗИ контралатерального яичка довольно часто обнаруживаются микрокальцинаты, что не должно рассматриваться как патология. Необходимо также регулярно определять уровни тестостерона, ЛГ и ФСГ. Риски рецидива и прогрессирования заболевания у больных герминогенной опухолью яичка сильно варьируют в зависимости от стадии и варианта лечения. Этим должна определяться интенсивность наблюдения. До сих пор нет достаточной информации об оптимальной стратегии наблюдения. Этот вопрос изучается в текущих исследованиях, результаты которых ожидаются. Поэтому конкретные рекомендации по организации наблюдения за больными с герминогенными опухолями яичка после лечения в настоящее время отсутствуют. Литература (с указанием степени научной доказательности)1. Collette L, Sylvester RJ, Stenning SP, Fossa SD, Mead GM, de Wit R, de Mulder
PHM, Neymark N, Lallemand E, Kaye SB. Impact of the treating institution on
survival of patients with „poor-prognosis“ metastatic nonseminoma. European
Organization for Research and Treatment of Cancer Genito-Urinary Tract Cancer
Collaborative Group and the Medical Research Council Testicular Cancer Working
Party. J Natl Cancer Inst 1999;91: 839-846. EBM III Correspondence: Материал подготовил к.м.н. Сорокин Константин Владимирович |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© Шадёркин И. А., 2005-2012 г.